获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS),也就是我们口中常说的艾滋病,源于一种逆转录病毒(HIV)的感染,该病毒可以破坏人类免疫系统,使免疫大军“敌我不分”,进而使许多细菌病毒趁虚而入,引发多种临床症状。
迄今为止,艾滋病都无法被人类治愈。
近日,来自美国斯克里普斯研究所的研究者们在HIV抗体的研究上获得重大发现。他们向4只家牛注射HIV包膜的模仿蛋白,在短短的一个多月的时间后,家牛快速产生了广谱中和抗体(broadly neutralizing antibodies, bNAb)。
中和抗体是通过抑制乃至中和抗原或感染源的生化功能,进而对细胞进行保护。要知道对于人类来讲,在HIV感染后只有一小部分的人会产生这种抗体,而且这个过程往往需要几年的时间。更让人兴奋的是,这种广谱中和抗体对117种HIV菌株的中和率更是高达96%!该项研究被发表在7月20日的《自然》杂志上。
来自约翰霍普金斯大学医学院的免疫学家Justin Bailey认为这项研究确定了“一种新且高效的HIV广谱抗体的产生方式”,但这项研究的意义并不仅限于此。如果研究者可以在人体中诱导出相似的抗体,这也意味着HIV疫苗的成功之路将就在眼前。

HIV是一种潜伏期极长的RNA病毒,直径约120纳米,呈20面体。病毒表面嵌有蛋白gp120与gp41,主要对人类免疫细胞进行攻击,使其感染并改变运作模式。其中以破坏T细胞膜上具有CD4蛋白识别功能的结果最为严重。一旦T细胞被感染,就意味着人体免疫系统门户大开,各种感染接踵而来,引发免疫缺陷综合征。
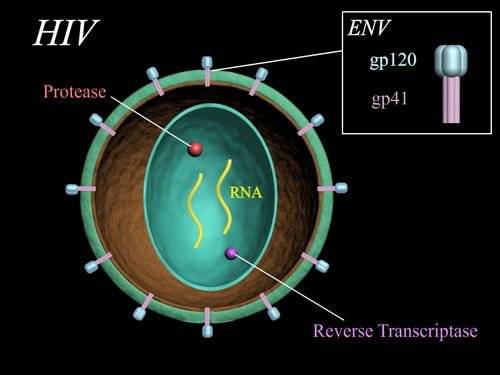
图 |HIV结构图
由于HIV的结构特点,它基本每时每刻都在变化,即使已经感染人类,它也可以在人体内发生突变,这就为HIV疫苗的研发增加了难度。针对单一HIV研发的抗体对其他病毒菌株只能望洋兴叹,而目前对于广谱中和抗体的研究并没有成功。
美国斯克里普斯研究所Dennis R. Burton及其同事通过模仿HIV包膜设计了BG505 SOSIP蛋白,对四头牛进行免疫注射,42天后四头牛都产生了广谱中和抗体。随后他们选取其中一头牛作为研究对象,提取血清中的抗体,并进行了更大规模的HIV测试--117种HIV菌株。在381天后,牛的抗体阻止了其中96%的病毒感染!而对另一头牛抗体的研究中,HIV中和率达到72%。

图 |美国斯克里普斯研究所Dennis R. Burton
这些牛的广谱中和抗体都有一个奇怪的结构特点——一段伸出去的氨基酸序列,就像一条伸出去的胳膊。这段被叫做HCDR3氨基酸基团可以与不同的HIV菌株中高度保守的位点结合。这段高度保守的结合位点同时也是HIV感染免疫细胞的关键,由于HIV具有厚厚的蛋白外壳,一般来说,这个结合位点很难被触碰到。
人类在被HIV感染后所产生的广谱中和抗体中,HCDR3一般是30个氨基酸左右的长度——对于一般的人类抗体来说,这已经差不多是2倍的长度了——但对于牛的抗体来说,“还只能算是短的”。该项目的研究者之一,Vaughn V. Smider说到,在牛的广谱中和抗体中,HCDR3区域甚至可以长达70个氨基酸。
这一特殊的结构特点,也许正是牛血清中的抗体能够阻止HIV感染的关键。

可惜的是,目前牛所产生的广谱中和抗体并不能应用在人体上,但这却可以解决科学家们心中长久以来的疑惑。“在它流行之初,我们就已经意识到HIV特别擅长逃避免疫系统的追击,所以无论是家牛还是人类,只要是免疫系统可以在自然条件下自主产生HIV的广谱中和抗体,这都值得引起我们的极大关注。”美国过敏与传染病研究所(NIAID)所长Anthony S. Fauci说到。
如果研究者可以在人体中诱导出含有长HCDR3的抗体,“这将意味着疫苗之路的真正起步,” Smider 说到,“在人类进行免疫之前,我们首先需要知道怎么能产生这种抗体。”接下来研究者将对此开展深入的研究,但毫无疑问的是,牛儿们已经准备好开始工作了。
-End-
参考:
https://www.sciencenews.org/article/cows-produce-powerful-hiv-antibodies
https://www.nih.gov/news-events/news-releases/nih-supported-scientists-elicit-broadly-neutralizing-antibodies-hiv-calves

责任编辑:

